Les kératines du cheveu
Une molécule de kératine est un assemblage macromoléculaire de chaînes polypeptidiques (nombreux acides aminés liés entre eux par liaisons peptidiques). Les protéines kératiniques du cheveu sont constituées par de nombreux acides aminés différents, dont voici quelques exemples:
|
Alanine |
|
|
Cystéine
|
|
|
Glycine
|
|
|
Méthionine
|
|
|
Sérine |
|
|
Tyrosine |
|
|
Valine
|
|
|
une molécule de cystéine en 3D |
|
Composition moyenne des kératines du cheveu: (chaque kératine ayant des proportions d'éléments différentes, les données suivantes sont une moyenne sommaire des éléments rencontrés dans le cheveu)
Carbone (C) 50 %
Oxygène (O) 22 %
Azote (N) 17 %
Hydrogène (H) 6 %
Soufre (S) 5 %
Structure de la kératine du cheveu:
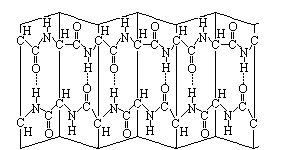
Les protéines kératiniques sont, comme nous l'avons vu plus haut, des assemblages macro moléculaires d'acides aminés. Les kératines, qui sont donc de longues chaînes polypeptidiques, sont allongées dans le sens du cheveu.
La cohésion tridimensionnelle de cet assemblage moléculaire est possible grâce à différentes liaisons chimiques. Ces liaisons peuvent être longitudinales (liaison entre deux parties d'une même chaîne polypeptidique), ou latérales (liaisons entre deux chaînes polypeptidiques différentes). On distingue les liaisons suivantes:
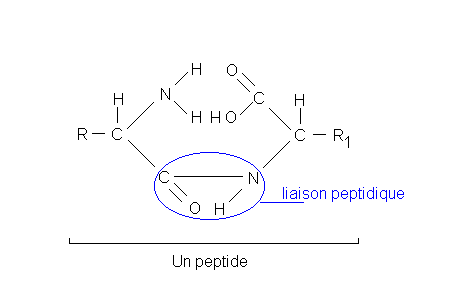
La liaison peptidique: Ce sont des liaisons covalentes fortes, qui permettent aux acides aminés de former de longues chaînes. Les liaisons peptidiques sont des liaisons longitudinales.
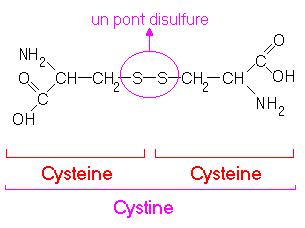
La liaison disulfure: C'est une liaison covalente, donc forte, permettant de relier deux chaînes entre elles. Cette liaison se fait entre 2 acides aminés soufrés comme la cystéine. Le soufre a ainsi un rôle important dans la solidité de la structure du cheveu. Deux molécules de cystéine appartenant à deux chaînes différentes s'assemblent pour former une molécule de cystine. La liaison soufre de la cystine représente un pont qui relie deux chaînes différentes entre elles. C'est pourquoi la liaison disulfure est aussi appelée pont cystine. Les liaisons disulfures sont des liaisons latérales. Les ponts cystine peuvent être rompus par des réducteurs (F thiols utilisés dans les liquides réducteurs en permanente).
La liaison saline: appelée aussi liaison ionique. Il s'agit d'une liaison électrovalentielle, non covalente et par conséquent assez faible. Elle s'établit entre un radical chargé positivement (ex: -NH3+ ) et un radical chargé négativement (ex: -COO- ).
On trouve ce type de liaison soit entre 2 parties d'une même chaîne polypeptidique, soit entre 2 chaînes différentes. Ce sont donc des liaisons qui peuvent être latérales ou longitudinales. La liaison saline est sensible aux acides, aux bases et à l'eau.
La liaison hydrogène: Ce sont des liaisons non covalente, faible, mais très nombreuses. Ces liaisons peuvent notamment s'établir entre les >C=O et les >N-H des liaisons peptidiques. Elles peuvent être intra-chaîne (longitudinales) ou inter-chaîne (latérales). Les liaisons hydrogène longitudinales permettent de maintenir la conformation hélicoïdale de la chaîne de kératine alpha. Ces liaisons se rompent facilement en présence d'eau.
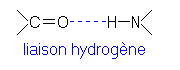
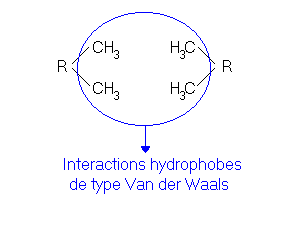
La liaison hydrophobe: Certains acides aminés ont une chaîne latérale hydrophobe (qui n'aime pas l'eau) et ne forment pas de liaisons hydrogène avec les molécules d'eau. Ces chaînes ainsi repoussées par les molécules d'eau, ont tendances à se rapprocher, permettant ainsi des interactions entre différentes parties d'une chaîne, mais également de deux chaînes différentes (forces de Van der Waals). Ce sont donc des liaisons qui peuvent être latérales ou longitudinales. La présence de molécules d'eau dans le cheveu renforce les liaisons hydrophobes (à cause de leur animosité avec l'eau). Mais ces liaisons sont sensibles aux agents tensioactifs.
La kératine peut prendre deux formes spatiales différentes:
- Etat hélicoïdal ou hélice alpha: La chaîne est maintenue dans cette configuration hélicoïdale grâce aux liaisons hydrogène intra-chaîne (F revoir le schéma "les différentes liaisons de la kératine")
- Etat étiré ou structure en feuillets plissés: Si on étire une fibre de kératine alpha, on obtient la kératine béta, en feuillets plissés (par exemple lors d'un lissage au brushing). Certaines protéines fibreuses sont naturellement dans cet état étiré (ex: fibroïne de la soie).