Dans un souci de simplification, chaque élément est représenté par une ou deux lettres. Exemples: l'oxygène est représenté par la lettre O, le carbone par la lettre C, le sodium par les lettres Na (du nom latin Natrium).
Les formules chimiques permettent de définir quantitativement et qualitativement une molécule. On distingue:
Exemple de la cystéine:
|
|
Formule brute: C3H7NO2S Formule semi-développée: NH2 - CH (CH2SH) - COOH Formule développée:
|
Un atome est constitué d'un noyau central autour duquel se déplacent un ou plusieurs électrons. Le noyau central est un groupement de nucléons: les protons et les neutrons. Les protons sont des particules qui ont une charge électrique positive, alors que les neutrons sont électriquement neutres. Les électrons ont chacun une charge négative et se déplacent autour du noyau à très grande vitesse. Dans un atome non ionisé, il y a toujours autant d'électrons que de protons. Comme l'atome contient autant de charges positives (protons) que de charges négatives (électrons), il est électriquement neutre.
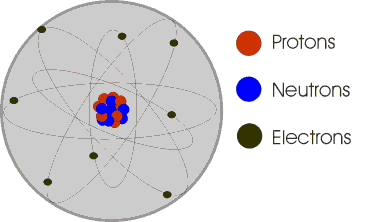
Les électrons ne se déplacent pas tous à la même distance du noyau. En fonction de leur niveau d'énergie, ils ont une trajectoire plus ou moins éloignée du noyau central. Contrairement aux fréquentes représentations (comme ci-dessous), les électrons ne se déplacent pas sur une orbite bien précise. Ils évoluent dans un nuage diffus dans lequel ils sont positionnés suivant leur probabilité de présence: le nuage électronique.
On distingue sept couches orbitales, représentées par les lettres K,L,M,N,O,P,Q. Chaque couche ne comporte qu'un nombre maximum d'électrons. Exemple: la couche K ne peut contenir au maximum que deux électrons, la couche L ne peut contenir que 8 électrons.
Un atome peut, de façon simplifiée, être représenté par des cercles concentriques.
Exemple de l'atome de Chlore ( Cl ) :
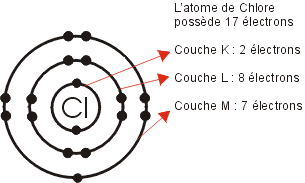
Les atomes se différencient par leur nombre de protons, de neutrons et d'électrons.
Un élément chimique est défini par son nombre de protons. Ainsi que nous le verrons dans le chapitre "classification des éléments", ce nombre de protons correspond au numéro atomique de l'élément.
F Le nombre de protons suffit pour définir un élément chimique.